허가사항과 다른 인공유방 판매중지 및 회수조치
이식환자 위험성 낮지만 지속적인 모니터링 필요
한스바이오메드 “책임 통감…향후 재발방지 약속”
【투데이신문 김효인 기자】 의료기기업체 한스바이오메드가 허가사항과 다른 원료로 만든 인공유방 7만여개를 전국 의료기관에 유통시킨 사실이 식약처에 적발됐다.
13일 식품의약품안전처(이하 식약처)에 따르면 한스바이오메드는 실리콘겔 인공유방인 ‘벨라젤’을 허가사항과 다른 원료로 제조·유통했다. 실리콘겔 인공유방은 유방을 재건하거나 성형하는데 사용된다.
식약처 점검결과, 해당 회사는 지난 2015년 12월부터 허가사항과 다른 원료를 사용해 생산한 7만여개의 부적합한 인공유방을 의료기관에 공급했다.
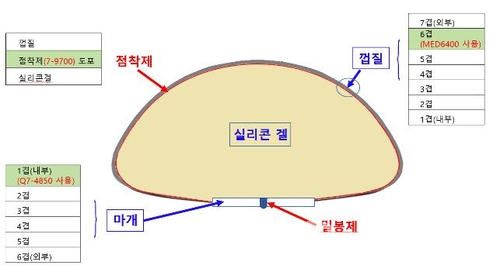
원료 중 제품허가사항에 기재되지 않은 원료는 총 5종이다. 이중 실리콘점착제(7-9700)는 피부접촉 의료기기(상처보호제)에 사용되는 원료이며, 나머지 4종은 실리콘마개원료(Q7-4850), 실리콘겔(MED2-6300), 실리콘막원료(MED-6400), 실리콘밀봉제(MED2-4213) 등으로 국내 허가된 다른 인체이식 의료기기(인공유방, 심장판막 등)의 제조에 사용된다.
식약처는 해당 인공유방 품목에 대한 판매중지 및 회수를 명령하고, 성형학회와 의사협회 등 관련 단체를 통해 의료기관에 해당 제품의 사용을 중지토록 협조 요청했다.
아울러 의료기기법 위반사항에 대한 업무정지 등 행정처분 조치에도 나선다. 이에 따라 한스바이오메드는 전제조업무정지 6개월의 행정처분을 받게 된다. 아울러 수사 결과에 따라 5년 이하의 징역 또는 5000만원 이하의 벌금이 부과될 수 있다.
식약처는 전문가 자문회의를 거친 결과 이번에 적발된 원료 5종이 대부분 다른 이식의료기기에 사용되는 원료인 점과 정상적 상태에서 누출 가능성이 적은 점 등을 들어 이식환자에 미칠 위험성은 낮다고 판단했다. 다만 이식환자에 대해서는 꾸준한 모니터링이 필요하다는 결론을 내렸다.
한편 해당 제품에 대해 인공유방 제조공정에서 발생하는 것으로 알려진 물질인 포름알데히드의 잔류시험을 진행한 결과, 해당 물질은 검출되지 않았다.
식약처는 현재 건강보험심사평가원을 통해 해당 제품을 이용해 유방재건술을 받은 환자 현황을 파악 중이다. 또 의료기관을 통해 개별 이식환자에게 정기검사 항목, 진단절차, 환자 대처요령 등의 정보를 제공한다는 방침이다. 한스바이오메드에는 이식환자에 대한 보상방안을 마련해 제출하도록 했으며, 진단·검사비, 부작용 시 보상대상·범위·기간을 조속히 확정한다는 계획이다.
식약처 관계자는 “향후 국민 안전을 위협하는 불법 의료기기 제조행위를 강력 처벌할 수 있도록 ‘보건범죄 단속에 관한 특별조치법’을 개정해 징벌적 과징금 제도를 도입하는 등 제도 개선을 추진하고 있다”고 말했다.
이와 관련 한스바이오메드 측은 재발방지를 약속했다.
한스바이오메드 관계자는 “고객 여러분에 심려를 끼쳐드린 점에 대해 무한한 책임을 통감한다”며 “비록 관련 제품이 안전하더라도 인허가 과정에서 발생한 위법 사항은 반드시 시정돼야 하고 이에 대한 책임을 질 예정이다”라며 “향후 재발 방지를 약속하고 이용 고객에 대한 추적관리 및 보상체계를 강화하겠다”고 말했다.
관련기사
주요기획: 김효인기자의 내맘대로 레트로 시리즈, 물티슈의 배신 시리즈, 젠더 이코노미 시리즈
좌우명: 盡人事待天命(진인사대천명) 다른기사 보기


