【투데이신문 김소희 기자】 명문제약의 고혈압약 ‘발사닌정’에서도 발암물질이 검출돼 판매중지 및 처방 제한 조치가 내려졌다.
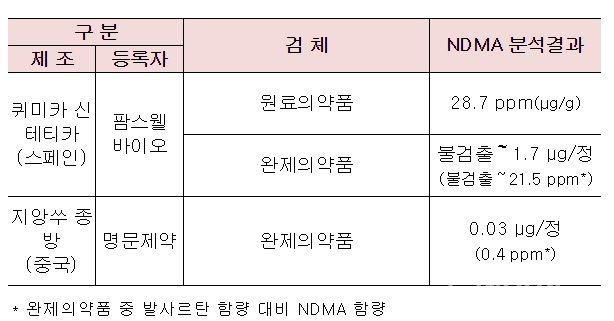
23일 식품의약품안전처(이하 식약처)는 앞서 중국 제지앙 화하이에서 제조한 발사르탄에서 N-니트로소디메틸아민(NDMA)이 검출된 이후 국내에서 수입·제조되는 모든(52개사, 86품목) 발사르탄 원료의약품에 대해 수거·검사를 진행한 결과 2개 품목에서 NDMA 잠정 관리기준(0.3ppm)을 초과했다고 밝혔다. 식약처는 기준치를 초과한 원료의약품과 해당 원료를 사용해 제조된 완제의약품에 대해 잠정 판매 및 제조 중지 조치를 내렸다.
문제가 된 발사르탄 원료의약품들은 스페인 퀴미카 신테티카(Quimica Sintetica)가 제조해 팜스웰바이오가 수입한 1개 품목과 중국 지앙쑤 종방(Jiangsu Zhongbang)이 제조한 명문제약 1개 품목이다.
다만 이번에 해당 원료 의약품을 사용해 추가로 판매 중지 및 처방이 제한되는 완제의약품은 명문제약의 ‘발사닌정80밀리그램’ 뿐이다. 팜스웰바이오의 발사르탄을 사용한 5개 완제의약품의 경우 이번 조사에 앞서 문제가 됐던 제지앙 화하이 발사르탄 사용으로 지난 7월 7일에 이미 판매가 중지됐다.
지난 2015~2017년까지 국내 전체 발사르탄 원료의약품 시장에서 팜스웰바이오 제품은 약 0.04%, 명문제약 제품의 비중은 0.07%을 차지했다. 명문제약의 발사닌정은 23일 오전 12시부터 건강보험심사평가원의 의약품안전사용서비스(DUR) 시스템을 통해 처방·조제가 차단됐고 건강보험 급여도 적용되지 않는다.
발사닌정을 복용 중인 환자수는 현재(23일 기준) 총 4048명이며 의약품 처방·조제 의료기관은 805개소(병원 311개, 약국 494개)이다.
식약처는 해당 발사르탄 원료의약품에서 NDMA 기준을 초과한 원인 등에 대해 면밀히 검토하고 있다. 발사르탄은 고혈압, 심부전, 심근경색 후의 사망위험성 감소 등에 쓰이는 의약품의 주성분인 원료의약품으로 혈관을 수축시키는 물질의 작용을 저지해 혈압을 떨어뜨린다. NDMA는 발사르탄 제조과정 중 불순물이 들어가면서 비의도적으로 생성되는 불순물로 세계보건기구(WHO) 산하의 국제 암연구소(IARC)가 사람에게 발암물질로 작용할 가능성이 있는 2A등급으로 분류한 바 있다.
식약처 관계자는 “해당 의약품을 복용 중인 환자들은 임의로 복용을 중단하지 말고 의약품을 처방받은 병·의원 등 의료기관에 상담을 거쳐 재처방 등을 받으라”고 당부했다.
한편, 보건복지부는 식약처 발표에 따라 이번에 판매가 중지된 의약품을 처방 받은 화자에 대한 조치방안을 마련해 운영한다고 밝혔다. 해당 의약품을 처방 받은 환자들의 경우 종전의 처방 받은 요양기관에 방문해 1회에 한해 본인부담금 없이 재처방, 재조제를 받을 수 있다. 또 의료기관을 방문할 수 없어 종전에 조제를 받았던 약국에 직접 방문하는 경우에도 의약품 교환이 가능하다.
잠정 판매중지 및 처방 제한 관련 제품 목록은 식약처, 보건복지부 홈페이지와 인터넷 포털사이트에 ‘고혈압약, 발사르탄, 고혈압치료제, NDMA’ 등을 검색해 확인할 수 있다.

